г. Москва и Московская область, Россия
Россия
Введение. Хронический тяжелый нейропатический болевой синдром, резистентный к консервативным и хирургическим методам лечения, остаётся серьёзной клинической проблемой. Хроническая электростимуляция лишь одной нервной структуры не всегда оказывается достаточно эффективным, что подчёркивает необходимость поиска инновационных подходов, одним из которых может являться комбинированная нейромодуляция. Целью данной статьи является представление клинического случая комбиниро-ванной электростимуляции спинного мозга и периферических нервов. Описание случая. Пациентка 32 лет с ятрогенным повреждением икро-ножного нерва после хирургического вмешательства, страдающая рефрактерным НБС (8 баллов по ВАШ). Неэффективность консервативной терапии (габапентин, дулоксетин) и хирургической коррекции (иссечение невромы) привела к применению хронической электростимуляции спинного мозга (SCS), что снизило боль на 30%. Последующая имплантация элек-трода для периферической стимуляции нерва (PNS) под УЗ-контролем в сочетании с SCS позволила достичь полного перекрытия зоны боли и снижения интенсивности до 1–2 баллов по ВАШ. Вывод. Сложности, связанные с применением комбинированной нейромо-дуляции (SCS + PNS) не должны препятствовать её применению. Удалённость электрода не играет значимой роли в функциональности системы. Комбинированная нейромодуляция продемонстрировала синергизм в лечении болевого синдрома, усиливая анальгетический эффект за счёт воздействия на центральные и периферические механизмы боли. Для рутинного использования в клинической практике требуются масштабные исследования, оценивающие безопасность и эффективность комбинированного подхода.
нейропатический болевой синдром, стимуляция спинного мозга (SCS), стимуляция периферических нервов (PNS).
Введение
Распространённость посттравматической невропатии, развивающейся в результате хирургических вмешательств, варьирует в диапазоне 3–15% [3]. Согласно исследованиям, от 6 до 30% пациентов с данной патологией страдают хроническим нейропатическим болевым синдромом [5]. В ряде исследований, посвящённых оценке эффективности консервативной терапии, демонстрируют, что достижение редукции болевого синдрома на 50% и более при монотерапии возможно лишь у 20-30% пациентов, а комбинированное применение фармакологических средств хоть и показывает лучший анальгетический эффект, но всё ещё не является панацеей [4]. Хирургические методы, включая невролиз и резекцию невром, демонстрируют эффект лишь в 50-70% случаев [6-7], что подчеркивает необходимость поиска инновационных подходов к лечению. В этой связи всё большую актуальность приобретают методы нейромодуляции, такие как хроническая электростимуляция спинного мозга (SCS) и периферических нервов (PNS). В представленной работе освещается клинический случай комбинированного применения данных методик у пациентки с хроническим фармакорезистентным нейропатическим болевым синдромом на фоне невропатии икроножного нерва, а также анализируются современные данные об их эффективности.
Описание клинического случая
Пациентка С., 32 лет, перенесла хирургическое удаление подкожной липомы, локализованной на дорсолатеральной поверхности левой стопы, кзади латеральной лодыжки. В раннем послеоперационном периоде манифестировал выраженный болевой синдром жгучего характера с иррадиацией по латеральной поверхности стопы, сопровождавшийся парестезиями и гипестезией пальцев. Интенсивность боли по визуальной аналоговой шкале (ВАШ) достигала 8 баллов. Неврологическое обследование и инструментальная диагностика подтвердили ятрогенное повреждение n. suralis в зоне операционного доступа. Последовательные попытки хирургической коррекции (иссечение краевой невромы) и консервативной терапии (габапентин 900 мг/сут, дулоксетин 60 мг/сут, венлафаксин 150 мг/сут) оказались неэффективными: отмечался кратковременный анальгетический эффект с последующим рецидивом боли до следующего приёма препаратов.В 2022 г. пациентке выполнена имплантация системы для хронической SCS на уровне Th10–Th12 (см.рис.1). Парестезии от стимуляции охватывали область боли на 80% и снижали выраженность болевого синдрома на 30%.
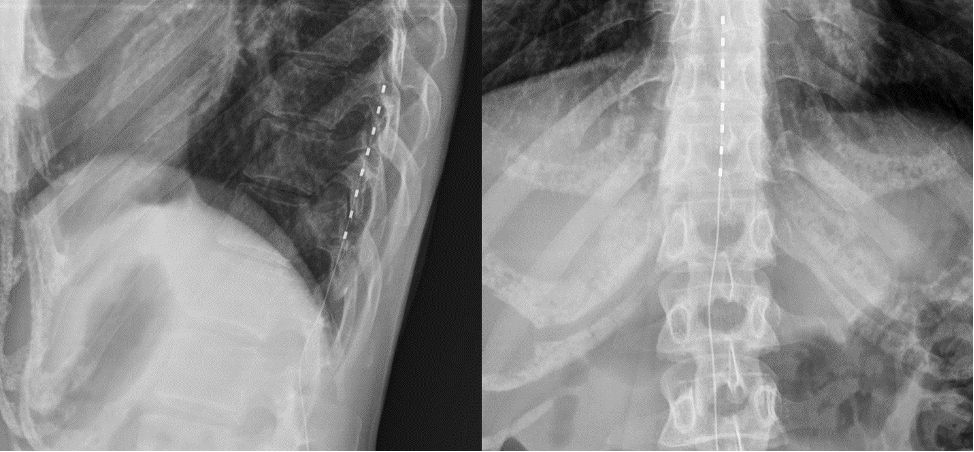 Рисунок 1. Рентгенологическая картина имплантированного электрода в заднее эпидуральное пространнство на уровне Th10-Th12 позвонков.
Рисунок 1. Рентгенологическая картина имплантированного электрода в заднее эпидуральное пространнство на уровне Th10-Th12 позвонков.
В 2023г. пациентка обратилась в ФГАУ «НМИЦ Нейрохирургии им.ак.Н.Н.Бурденко» Минздрава России. Ей было предложено выполнение блокады икроножного нерва, что и было выполнено. Отметился полный регресс болевого синдрома на время действия местного анестетика с полным рецидивом болевого синдрома на 2-3 день после блокады. В связи с этим пациентке было решено проведение имплантации электрода для хронической электростимуляции икроножного нерва под УЗИ-контролем. На задне-латеральной поверхности голени выполнен линейный разрез длиной 3 см, через который под ультразвуковым контролем идентифицирован ствол икроножного нерва. С использованием иглы Туи произведена имплантация электрода параллельно ходу икроножного нерва с последующей фиксацией в области разреза толстой нерассасывающейся шелковой нитью (5 metric). (рис.2,3).
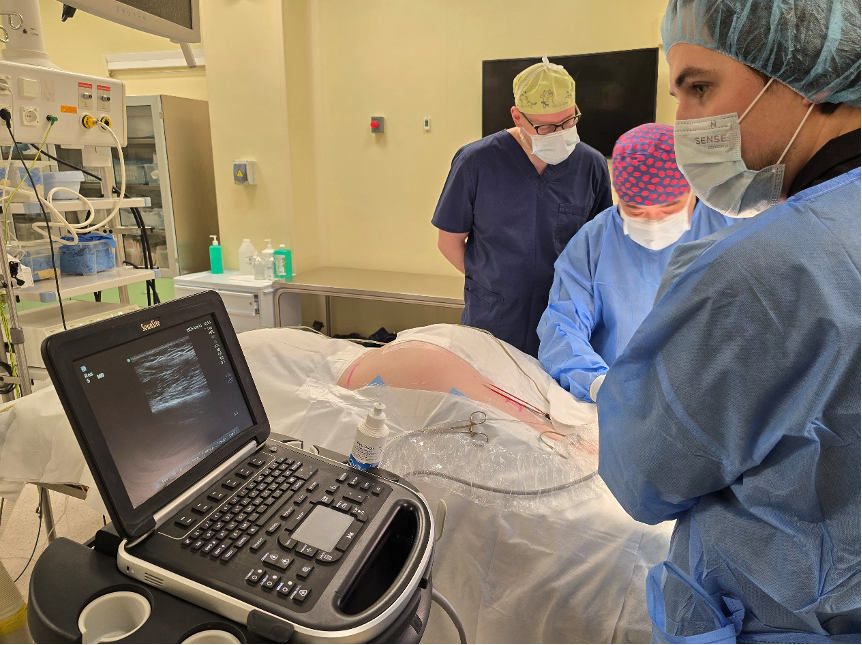 Рисунок 2. Фото из операционной. Имплантация электрода на икроножный нерв под УЗИ-контролем.
Рисунок 2. Фото из операционной. Имплантация электрода на икроножный нерв под УЗИ-контролем.
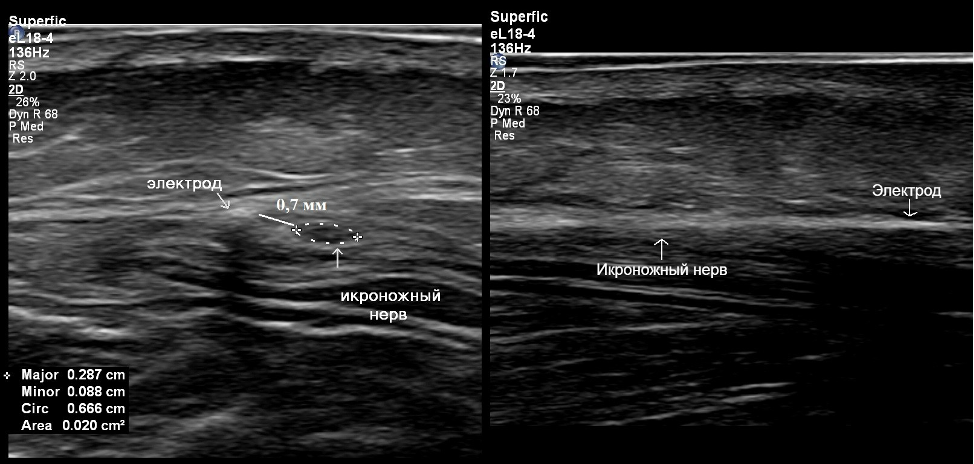 Рисунок 3. УЗ-картина имплантированного электрода. Слева – поперечное сканирование: электрод и икроножный нерв подписаны. Видно, что электрод идёт вдоль ствола икроножного нерва на расстоянии от него менее 1 мм. Справа – продольное сканирование: вывести электрод и нерв в одну плоскость крайне затруднительно из-за их взаимного расположения, но можно визуализировать тень от электрода и эпиневрий икроножного нерва.
Рисунок 3. УЗ-картина имплантированного электрода. Слева – поперечное сканирование: электрод и икроножный нерв подписаны. Видно, что электрод идёт вдоль ствола икроножного нерва на расстоянии от него менее 1 мм. Справа – продольное сканирование: вывести электрод и нерв в одну плоскость крайне затруднительно из-за их взаимного расположения, но можно визуализировать тень от электрода и эпиневрий икроножного нерва.
Основной сложностью стало проведение дистального конца электрода к верхнеягодичной области, где у пациентки ранее был установлен подкожный генератор импульсов. С учетом роста пациентки в 170 см, расстояние от латеральной лодыжки до генератора составило около 100 см, что потребовало создания системы петель для компенсации движений в суставах. В верхней трети голени и средней трети бедра выполнены дополнительные разрезы по 2 см, через которые по подкожному туннелю проведены удлинители длиной 55 см и 35 см, а также сформированы две компенсаторные петли(рис.4). Это позволило достичь общей длины системы 140 см, исключив риск натяжения электрода при сгибательно-разгибательных движениях конечности. Далее проведена проверка импеданса, который не вышел за пределы нормальных значений. Закончилась операция послойным ушиванием раны.
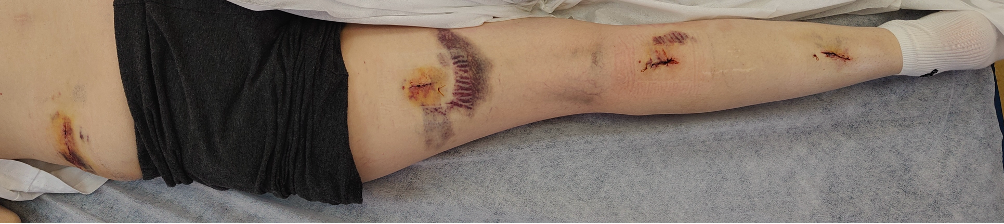 Рисунок 4. Фото послеоперационных ран на 3 сутки после операции. Отмечается несколько гематом в ложе кармана петель, но клинически значимого эффекта они не имели и самостоятельно прошли через несколько недель.
Рисунок 4. Фото послеоперационных ран на 3 сутки после операции. Отмечается несколько гематом в ложе кармана петель, но клинически значимого эффекта они не имели и самостоятельно прошли через несколько недель.
На следующий день проведена настройка программы нейростимуляции, область боли была перекрыта полностью. Комбинированная нейростимуляция (SCS + PNS) позволила снизить интенсивность НБС до 1–2 баллов по ВАШ. Через 24 месяца наблюдения отмечено истощение ресурса имплантированного генератора импульсов, потребовавшее его замены. Медикаментозная терапия сохраняется в прежнем объёме.
Обсуждение
Представленный клинический случай иллюстрирует потенциал комбинированной нейромодуляции в лечении сложного болевого синдрома. Согласно результатам рандомизированных контролируемых исследований (РКИ), монотерапия PNS обеспечивает снижение боли ≥50% у 38% пациентов с посттравматической невропатией [2], тогда как систематический обзор указывают на вариабельность эффективности метода (38–78%) в зависимости от этиологии и локализации повреждения [1]. SCS достигает анальгетического эффекта у 50–70% пациентов [2, 8]. В литературе описано несколько клинических случаев комбинированного применения PNS и SCS с более выраженным анальгетическим эффектом нежели применение только одного этого метода. [9-12]
Механизм синергизма, вероятно, связан с одновременной модуляцией как спинальных, так и периферических звеньев ноцицептивной передачи. SCS воздействует на дорсальные рога спинного мозга, подавляя центральную сенситизацию, тогда как PNS блокирует периферическую гипервозбудимость повреждённого нерва [9]. Однако отсутствие РКИ, посвящённых комбинированной стимуляции, ограничивает доказательную базу, а повышенный риск осложнений (миграция электродов, интраоперационное повреждение структур, инфекции) требует тщательного отбора пациентов, выполнения операций и наблюдения в послеоперационном периоде.
Также особенностью этого клинического случая является удалённость электрода от генератора. Зачастую, при имплантации электрода на нервы голени генератор имплантируется в область латеральной поверхности бедра. Однако здесь уже был имплантированный генератор, и единственной опцией было использование нескольких удлинителей для преодоления этого расстояния и минимизации риска натяжения электрода и удлинителей, чего нам и удалось добиться. При этом, значимого повышения импеданса в цепи не было, он был в районе 800, что позволило использовать низкую амплитуду и экономить заряд батареи генератора.
Заключение
Терапия хронического нейропатического болевого синдрома, резистентного к консервативным методам, требует мультимодального подхода, интегрирующего фармакотерапию, интервенционные и нейромодуляционные методики. Комбинированная электростимуляция (SCS + PNS) представляет собой перспективное направление, позволяющее усилить анальгетический эффект за счёт воздействия на различные патогенетические звенья болевого синдрома. Удалённость планируемой цели для стимуляции не должна являться противопоказанием к применению комбинации методов. Тем не менее, внедрение данной стратегии в клиническую практику должно сопровождаться проведением масштабных РКИ для оценки долгосрочной эффективности и безопасности, а также разработкой алгоритмов индивидуализированного подхода к выбору метода нейромодуляции.
1. Xu J, Sun Z, Wu J, et al. Peripheral Nerve Stimulation in Pain Management: A Systematic Review. Pain Physician. 2021;24(2):E131-E152. DOI: https://doi.org/10.36076/ppj.2021.24.E131-E152
2. Deer TR, Mekhail N, Provenzano D, et al. The appropriate use of neurostimulation: avoidance and treatment of complications of neurostimulation therapies for the treatment of chronic pain. Neuromodulation Appropriateness Consensus Committee. Neuromodulation. 2014;17(6):571-598. doihttps://doi.org/10.1111/ner.12206
3. Kretschmer T., Heinen C.W., Antoniadis G. et al. "Iatrogenic nerve injuries." Neurosurg Clin N Am. 2009;20(1):73-90. DOI:https://doi.org/10.1016/j.nec.2008.07.025
4. Давыдов О.С., Яхно Н.Н., Кукушкин М.Л. и др. Невропатическая боль:клинические рекомендации по диагностике и лечению Российского общества изучения боли. DOI:https://doi.org/10.25731/RASP.2018.04.025
5. Яхно Н.Н., Кукушкин М.Л., Данилов А.Б. с соавт. Результаты Российского эпидемиологического исследования распространенности невропатической боли, ее причин и характеристик в популяции амбулаторных больных, обратившихся к врачу-неврологу. Боль, 2008, 3: 24-32. EDN: https://elibrary.ru/JVAEDR
6. Блэнтон Н., Буй П., Риззо Д. Neurologists, neuroctomy, and grafting for chronic lower extremity pain following major rearfoot reconstruction // The Foot and Ankle Online Journal. – 2019. – Vol. 12. – No 4. – Art. 2. – DOI:https://doi.org/10.3827/faoj.2019.1204.0002.
7. Gosk J, Rutowski R, Rabczyński J. Original article The lower extremity nerve injuries – own experience in surgical treatment. Folia Neuropathologica. 2005;43(3):148-152.
8. Kumar K, Taylor RS, Jacques L, et al. Spinal cord stimulation versus conventional medical management for neuropathic pain: a multicentre randomised controlled trial in patients with failed back surgery syndrome. Pain. 2007;132(1-2):179-188. doihttps://doi.org/10.1016/j.pain.2007.07.028
9. Baxter AL, Thrasher A, Etnoyer-Slaski JL, Cohen LL. Multimodal mechanical stimulation reduces acute and chronic low back pain: Pilot data from a HEAL phase 1 study. Front Pain Res (Lausanne). 2023;4:1114633. Published 2023 Apr 26. doihttps://doi.org/10.3389/fpain.2023.1114633 EDN: https://elibrary.ru/XYZEFC
10. Lipov EG. 'Hybrid neurostimulator': simultaneous use of spinal cord and peripheral nerve field stimulation to treat low back and leg pain. Prog Neurol Surg. 2011;24:147-155. doihttps://doi.org/10.1159/000323047
11. Bernstein CA, Paicius RM, Barkow SH, Lempert-Cohen C. Spinal cord stimulation in conjunction with peripheral nerve field stimulation for the treatment of low back and leg pain: a case series. Neuromodulation. 2008;11(2):116-123. doihttps://doi.org/10.1111/j.1525-1403.2008.00152.x
12. Choi JH, Choi SC, Kim DK, et al. Combined Spinal Cord Stimulation and Peripheral Nerve Stimulation for Brachial Plexopathy: A Case Report. Pain Physician. 2016;19(3):E459-E463. DOI: https://doi.org/10.36076/ppj/2019.19.E459




