Москва, г. Москва и Московская область, Россия
Введение: Нейропатическая боль возникает вследствие повреждений и заболеваний соматосенсорной нервной системы и может значительно ухудшать качество жизни. Для лечения ХНБ применяются как консервативные, так и интервенционные методы лечения. В фармакорезистентных случаях ХНБ возможно применение хирургических методов лечения боли. Материалы и методы: Проведен анализ анатомических и функциональных особенностей интраламинарной группы ядер таламуса. Проведена оценка центрально-латеральных ядер таламуса в качестве «таргета» для проведения противоболевых вмешательств транскраниальным МР-направленным фокусированным ультразвуком. Результаты: Эффективность вмешательств по данным разных авторов составляла 18-100%. Эффективность относительно ноцицептивной боли составляла в среднем 46%, а в отношении нейропатической боли – 29%. Однако с внедрением фокусированного ультразвука (ФУЗ) в клиническую практику, и с более широким применением в качестве мишени CL, удалось значимо повысить результаты лечения пациентов с нейропатической болью. Выводы: Несмотря на отсутствие публикаций с высоким уровнем доказательности об эффективности деструктивных вмешательств на головном мозге в лечении хронических болевых синдромов, центрально-латеральная таламотомия (CLT) методом ФУЗ является одним из перспективных направлений развития инвазивных методов лечения боли, в том числе ввиду низких рисков развития осложнений.
Фокусированный ультразвук; МР-ФУЗ; Нейропатическая боль, центрально-латеральная таламотомия
Введение
Нейропатическая боль возникает вследствие повреждений и заболеваний соматосенсорной нервной системы и может значительно ухудшать качество жизни1. Согласно результатам исследований частота встречаемости Хронической нейропатической боли (ХНБ) в популяции составляет 7-9%2. При некоторых патологических состояниях количество пациентов с ХНБ значительно выше (Ампутации конечностей, авульсии корешков и сплетений, онкологические заболевания и т.д.). Международной ассоциацией по изучению болт (IASP) создано подразделение по ХНБ. Опубликованы различные рекомендации по диагностике и лечению ХНП. В установке диагноза ХНБ применяются классические методы исследования (в том числе нейровизуализация), различные шкалы и опросники (VAS, DN-4, Pain Detect, MPQ, LANSS и т.д.). Немаловажным диагностическим этапом является оценка психического статуса пациента, а также комплаентности. Для лечения ХНБ применяются как консервативные (в том числе многокомпонентная фармакотерапия), так и интервенционные методы лечения. В фармакорезистентных случаях ХНБ возможно применение хирургических методов лечения боли (нейромодуляция, имплантация устройств для интратекальной терапии). Разработаны и опубликованы различные алгоритмы поэтапного лечения ХНБ3.
Несмотря на обширные возможности терапии у некоторых пациентов не удается достичь удовлевторительных результатов лечения, что значимо снижает качество жизни. В подобных ситуациях в алгоритм лечения могут быть включены стереотаксические нейрохирургические вмешательства на головном мозге (глубокая стимуляция головного мозга - DBS, деструктивные вмешательства). Российские рекомендации по ХНБ опубликованы в 2016г (Ассоциация Нейрохирургов России), и в 2018г (РОИБ). Стоит отметить, что на момент публикации имелся опыт единичных деструктивных операций на головном мозге при болевых синдромах. В рекомендациях АНР указывается возможность проведения DBS как опции в лечении невропатической боли.
Материалы и методы
Проведен поиск работ в отечественных и зарубежных источниках с ключевыми словами «центрально-латеральная таламотомия», «Central-lateral thalamotomy». Проведен анализ анатомических и функциональных особенностей интраламинарной группы ядер таламуса. Проведена оценка центрально-латеральных ядер таламуса в качестве «таргета» для проведения противоболевых вмешательств транскраниальным МР-направленным фокусированным ультразвуком. Также проанализирован отчет FUS Foundation о проведенных вмешательствах на головном мозге с использованием ФУЗ за 2025г.
Результаты
Анатомические и физиологические особенности итраламинарной группы ядер таламуса в основном изучены на животных моделях. Считается, что внутри тонкой пластины миелинизированных волокон (lamina medullaris thalami), проходящих в таламусе в рострокаудальном направлении, располагаются несколько групп ядер (передняя и задняя группа интраламинарных ядер таламуса), вовлеченных в том числе в передачу ноцицептивной информации в кору головного мозга, а также в формировании аффективного компонента боли4;5. К интраламинарной группе ядер таламуса относят – Центральное медиальное ядро (CeM); парацентральное и центрально-латеральное ядра (CL); заднее интраламинарное, центромедианное (CM), парафасцикулярное(Pf) и субпарафасцикулярное ядра (sPf)6;7. Наиболее крупным из указанных ядер является CL ядро, которое имеет сложную геометрическую форму8. Считается, что CL и центромедианный-парафасцикулярный комплекс получают афферентную информацию по спиноталамическим трактам (афферентация из дорзальных ганглиев), от спинномозговых ядер тройничных нервов, а также связаны с зонами проведения болевой афферентации ствола головного мозга и ретикулярной формации9.
Стереотаксические нейрохирургические вмешательства с целью купирования болевого синдрома проводяться с 50-х годов 20-го века, однако в большинстве описанных серий в качестве «таргета» выбирали CM, гораздо реже CL10;11;12;13. Следует отметить, что медиальные таламотомии считались безопасными хирургическими вмешательствами. Эффективность вмешательств по данным разных авторов составляла 18-100%. Эффективность относительно ноцицептивной боли составляла в среднем 46%, а в отношении нейропатической боли – 29%. Однако с внедрением фокусированного ультразвука (ФУЗ) в клиническую практику, и с более широким применением в качестве мишени CL, удалось значимо повысить результаты лечения пациентов с нейропатической болью14; 15; 16.
ФУЗ позволяет проводить воздействие на подкорковых структурах головного мозга в пределах 3.0-3.5см от мидкомиссуральной линии, не прибегая к проведению открытого хирургического вмешательства. Воздействие проводится путем контролируемого нагревания зоны интереса с использованием термометрии в реальном времени. После проведения «пробного» воздействия (нагревание до 45оС) оценивается терапевтический эффект, а также отсутствие побочных явлений. Следующим этапом проводятся лечебные соникации с достижением термокоагуляции (как правило выше 50оС). Достижение температуры в 60оС вызывает мгновенное формирование очага деструкции17. Однако при воздействии на интраламинарную группу ядер таламуса, некоторые авторы рекомендуют воздержаться от нагревания очага воздействия до 60оС и выше с целью снижения рисков развития осложнений18. Следует отметить, что при проведении ФУЗ возможно корректировка зоны воздействия, а также проведение одномоментных двусторонних вмешательств. Особенностью использования метода является малотравматичность, что в свою очередь позволяет проводить хирургическое лечение пациентам старшей возрастной группы, а также с тяжелой соматической патологией, препятствующей проведению открытых хирургических вмешательств. Основными ограничениями/противопоказаниями к проведению ФУЗ являются – низкий SDR (Коэффициент ультразвуковой проводимости костных структур), клаустрофобия, наличие в теле пациента имплантов, исключающих возможность проведение магнитно-резонансной томографии (МРТ), органические изменения структуры головного мозга, а также новообразования, артерио-венозные мальформации (АВМ) головного мозга и т.д.
Согласно отчету FUS Foundation – менее 1% лечений с использованием транскраниального ФУЗ проводятся у пациентов с болевыми синдромами19. В опубликованных работах основной мишенью для лечения болевых синдромов методом ФУЗ являются CL и VPL ядра таламуса20. Однако с учетом возможности проведения как деструкции, так и нейромодуляции фокусированным ультразвуком, возможно расширение списка «таргетов» для проведения вмешательств. В Российской федерации ФУЗ внедрен с 2020г, в основном применяется для лечения экстрапирамидных заболеваний (Эссенциальный тремор, болезнь Паркинсона). В условиях «ФГБНУ Российского Центра Неврологии и Нейронаук» проведены несколько хирургических вмешательств транскраниальным МР-направленным фокусированным ультразвуком для лечения хронических болевых синдромов. В качестве «мишени» использовались CL ядра таламуса - как билатерально, так и унилатерально (рис. 1). Следует отметить, что вероятность изолированного воздействия на CL низкая, и при проведении стереотаксических вмешательств по поводу болевых синдромов (как радиочастотным методом, так и с использованием лучевой терапии и ФУЗ), воздействие охватывает и другие структуры, расположенные в непосредственной близости от CL. С учетом короткого катамнеза, результаты лечения пациентов не отражены в данной работе.
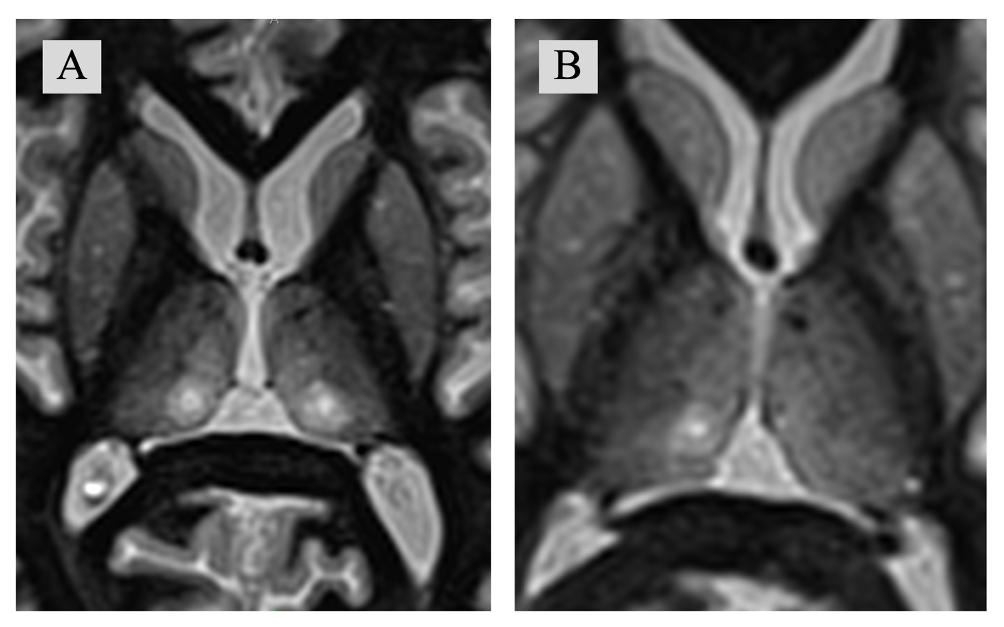 Рисунок 1: На послеоперационных снимках в аксиальной плоскости на уровне соответствующему D7 по стереотаксическому атласу Morel et. Al представлены А – Очаги воздействия после билатеральной CLT; B – Очаг деструкции после правосторонней CLT. (CLT: Центрально-латеральная таламотомия).
Рисунок 1: На послеоперационных снимках в аксиальной плоскости на уровне соответствующему D7 по стереотаксическому атласу Morel et. Al представлены А – Очаги воздействия после билатеральной CLT; B – Очаг деструкции после правосторонней CLT. (CLT: Центрально-латеральная таламотомия).
Выводы
Несмотря на отсутствие публикаций с высоким уровнем доказательности об эффективности деструктивных вмешательств на головном мозге методом МР-ФУЗ в лечении хронических болевых синдромов, ФУЗ является одним из перспективных направлений развития инвазивных методов лечения боли, в том числе ввиду низких рисков развития осложнений. Ключевым фактором в проведении ФУЗ является тщательный отбор пациентов мультидисциплинарной командой специалистов.
Дальнейшие исследования позволят определить критерии отбора пациентов с болевыми синдромами для проведения ультразвуковых терапевтических воздействий на головном мозге, выявить наиболее эффективные зоны воздействия («таргет»), выбрать оптимальные параметры ультразвукового воздействия.
1. Finnerup NB, Kuner R, Jensen TS. Neuropathic Pain: From Mechanisms to Treatment. Physiol Rev. 2021 Jan 1;101(1):259-301. doi:https://doi.org/10.1152/physrev.00045.2019. Epub 2020 Jun 25. PMID: 32584191. EDN: https://elibrary.ru/KOBFPA
2. Baskozos G, Hébert HL, Pascal MM, Themistocleous AC, Macfarlane GJ, Wynick D, Bennett DL, Smith BH. Epidemiology of neuropathic pain: an analysis of prevalence and associated factors in UK Biobank. Pain Rep. 2023 Mar;8(2):e1066. doi:https://doi.org/10.1097/PR9.0000000000001066. PMID: 37090682; PMCID: PMC7614463. EDN: https://elibrary.ru/AFHSTM
3. Bates D, Schultheis BC, Hanes MC, Jolly SM, Chakravarthy KV, Deer TR, Levy RM, Hunter CW. A Comprehensive Algorithm for Management of Neuropathic Pain. Pain Med. 2019 Jun 1;20(Suppl 1):S2-S12. doi:https://doi.org/10.1093/pm/pnz075. Erratum in: Pain Med. 2023 Feb 1;24(2):219. doi:https://doi.org/10.1093/pm/pnac194. PMID: 31152178; PMCID: PMC6544553.
4. Benarroch EE. The midline and intralaminar thalamic nuclei—Anatomic and functional specificity and implications in neurologicdisease. Neurology. 2008;71(12):944-949. DOI: https://doi.org/10.1212/01.wnl.0000326066.57313.13
5. Groenewegen HJ, Berendse HW. The specificity of the nonspecific midline and intralaminar thalamic nuclei. Trends Neurosci. 1994; 17(2):52-57. DOI: https://doi.org/10.1016/0166-2236(94)90074-4
6. Morel, A. Stereotactic Atlas of the Human Thalamus and Basal Ganglia (CRC Press, 2007). DOI: https://doi.org/10.3109/9781420016796
7. Jones, E. G. Thalamus 2 Vol. Set (2007).
8. Kumar VJ, Scheffler K, Grodd W. The structural connectivity mapping of the intralaminar thalamic nuclei. Sci Rep. 2023 Jul 24;13(1):11938. doi:https://doi.org/10.1038/s41598-023-38967-0. PMID: 37488187; PMCID: PMC10366221.
9. Romanelli P, Esposito V, Adler J. Ablative procedures for chronic pain. Neurosurg Clin N Am. 2004;15(3):335-342. DOI: https://doi.org/10.1016/j.nec.2004.02.009
10. Hécaen H, Talairach J, David M, Dell M. Coagulations limitees du thalamus dans les algies du syndrome thalamique-resultats therapeutiques et physiologiques. Rev Neurol (Paris). 1949;81(11):917-931.
11. Talairach J, Hecaen H, David M, Monnier M, Deajuriaguerra J. Recherches sur la coagulation thérapeutique des structures sous-corticales chez lhomme. Rev Neurol (Paris). 1949;81(1):4-24.
12. Monnier M, Fischer R. Stimulation électrique et coagulation thérapeutique du thalamus chez l’homme (névralgies faciales). Stereotact Funct Neurosurg. 1951;11(5):282-286. DOI: https://doi.org/10.1159/000105649
13. Abosch A, Lozano AM. Stereotactic ablative procedures for pain relief. Thieme Medical Publishers, Inc.; 2004. p 195-202. DOI: https://doi.org/10.1055/s-2004-835708
14. Jeanmonod D, Magnin M, Morel A. Thalamus and neurogenic pain: Physiological, anatomical and clinical data. Neuroreport: An International Journal for the Rapid Communication of Research in Neuroscience. 1993;4(5):475–478. DOI: https://doi.org/10.1097/00001756-199305000-00003
15. Arnts H, Coolen SE, Fernandes FW, Schuurman R, Krauss JK, Groenewegen HJ, van den Munckhof P. The intralaminar thalamus: a review of its role as a target in functional neurosurgery. Brain Commun. 2023 Feb 2;5(3):fcad003. doi:https://doi.org/10.1093/braincomms/fcad003. PMID: 37292456; PMCID: PMC10244065.
16. Jeanmonod D, Werner B, Morel A, Michels L, Zadicario E, Schiff G, Martin E. Transcranial magnetic resonance imaging-guided focused ultrasound: noninvasive central lateral thalamotomy for chronic neuropathic pain. Neurosurg Focus. 2012 Jan;32(1):E1. doi:https://doi.org/10.3171/2011.10.FOCUS11248. PMID: 22208894.
17. Wintermark M, Druzgal J, Huss DS, Khaled MA, Monteith S, Raghavan P, Huerta T, Schweickert LC, Burkholder B, Loomba JJ, Zadicario E, Qiao Y, Shah B, Snell J, Eames M, Frysinger R, Kassell N, Elias WJ. Imaging findings in MR imaging-guided focused ultrasound treatment for patients with essential tremor. AJNR Am J Neuroradiol. 2014 May;35(5):891-6. doi:https://doi.org/10.3174/ajnr.A3808. Epub 2013 Dec 26. PMID: 24371027; PMCID: PMC7964546.
18. Allam AK, Larkin MB, McGinnis JP, Viswanathan A. Neuroablative central lateral thalamotomy for chronic neuropathic pain. Front Pain Res (Lausanne). 2022 Sep 13;3:999891. doi:https://doi.org/10.3389/fpain.2022.999891. PMID: 36176711; PMCID: PMC9513204.
19. https://cdn.fusfoundation.org/2025/07/31085318/FUSF-State-of-the-Field-2025_July-31.pdf
20. Nüssel M, Zhao Y, Knorr C, Regensburger M, Stadlbauer A, Buchfelder M, Del Vecchio A, Kinfe T. Deep Brain Stimulation, Stereotactic Radiosurgery and High-Intensity Focused Ultrasound Targeting the Limbic Pain Matrix: A Comprehensive Review. Pain Ther. 2022 Jun;11(2):459-476. doi:https://doi.org/10.1007/s40122-022-00381-1. Epub 2022 Apr 26. PMID: 35471626; PMCID: PMC9098763. EDN: https://elibrary.ru/SVUPGG




